Eletroquímica
Eletroquímica
Oxidação: é a perda de elétrons.
Fe0 -> Fe+2 + 2 elétrons
ferro -> ferrugem
Redução: é o ganho de elétrons.
Al+3 + 3 elétrons -> Al
Os processos de oxidação e redução são simultâneos.
Tabela de Nox fixo
Toda substância simples, metais
Ex: H2(g), O2(g), O3(g), Fe0(s), Hg0(s), Ne0, He0, Ni0(s)...
| Família / Elemento | Nox (carga) |
|---|---|
| 1A e Ag | +1 |
| 2A e Zn | +2 |
| 3A | +3 |
| 5A | -3 |
| 6A | -2 |
| 7A | -1 |
| Oxigênio | -2 |
| Hidrogênio | +1 |
Como Calcular o Nox de um elemento?
Regras:
* Em uma substância neutra a soma de todas as cargas deve ser zero.
* Em íons (cátions e ânions) a soma das cargas deve ser igual a carga aparente do íon.
Reações de Oxirredução
São aquelas que sofrem mudanças no Nox dos elementos conforme vão ocorrendo. Podemos também dizer que a reação de oxirredução ocorre quando há transferências de elétrons.
Como vimos anteriormente:
Oxidação -> é a perda de elétrons e há aumento do Nox.
Redução -> é o ganho de elétrons e há diminuição do Nox.
Vimos também que a oxidação e a redução são processos simultâneos.
Ex:
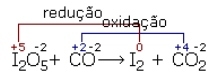
Agente oxidante: é a espécie química que sofreu redução na reação. Ele provoca oxidação em alguém.
Agente redutor: é a espécie que sofreu oxidação, ou seja, ele provoca a redução em alguém.
Pelo exemplo acima, temos que o agente oxidante é I2+5 e o agente redutor é o C+2.
Fonte: https://www.infoescola.com/quimica/eletroquimica/
Pilhas e Baterias
As pilhas e baterias são dispositivos em que reações de oxirredução transformam energia química em elétrica. Elas são estudadas em um ramo específico da Eletroquímica.

Diferentes tipos de pilhas e baterias usados em um centro de reciclagem em 16 de julho de 2013, em Fairfax*
As pilhas e as baterias são dispositivos estudados em Eletroquímica que transformam energia química em energia elétrica. Dentro desses aparelhos ocorrem reações de oxirredução, em que há transferência de elétrons, produzindo assim corrente elétrica.
A diferença entre as pilhas e baterias está no fato de que as pilhas, também chamadas de células eletroquímicas, são formadas por dois eletrodos (positivo (cátodo) e negativo (ânodo)) onde ocorrem respectivamente as semirreações de redução e oxidação, além de um eletrólito, que é uma solução condutora de íons.
Já as baterias são formadas por várias pilhas ligadas em série ou em paralelo. Graças a isso, as baterias produzem uma corrente elétrica muito mais forte que as pilhas.
Além disso, as pilhas e baterias podem ser divididas em primárias (não recarregáveis) e secundárias (recarregáveis).
Veja como esses dispositivos tão comuns em nosso cotidiano foram inventados, como eles funcionam e quais são indicados para cada equipamento, lendo os textos:
Ameaça das baterias de celular - https://www.brasilescola.com/quimica/ameaca-das-baterias-celular.htm
Bateria de última geração - https://www.brasilescola.com/quimica/bateria-ultima-geracao.htm
Pilhas e Baterias de Lítio - https://www.brasilescola.com/quimica/pilhas-baterias-litio.htm
